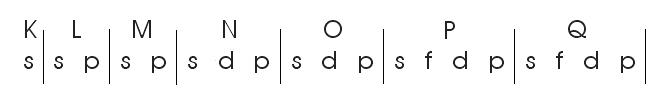Modelo Atômico de Orbitais Geométricos – M.A.O.G.
Ericsson Augusto de Matos
© Maio de 2008
Divulgação autorizada para o ECC
Para ler o artigo em pdf clique aqui
Introdução
Várias teorias explicativas dos modelos atômicos foram desenvolvidas no último século. Dentre elas, o modelo atômico de Niels Bohr [1] explica que o átomo é composto de camadas de elétrons organizadas em níveis de energia. Em cada nível de energia “n”, o número de elétrons, deve aumentar segundo uma equação 2n², implicando em níveis com 2, 8, 18, 32, 50 elétrons, e assim por diante.
Outra teoria, de Arnold Sommerfeld [1], concluiu que as órbitas eletrônicas deveriam ser elípticas, e não circulares, como imaginou Niels Bohr, e que cada nível energético deveria comportar subníveis, os quais foram apresentados como s, p, d, f, g, h, i e assim por diante.
Uma teoria de distribuição dos elétrons foi proposta por Linus Pauling [1], resultando num diagrama que apresenta sobre os níveis de energia propostos por Niels Bohr uma sequência ordenada de distribuição segundo uma ordem crescente de energia dos elétrons.
Outra teoria, desenvolvida por Kossel e Lewis, a teoria do octeto, diz que um átomo não pode apresentar mais do que 8 elétrons no seu último nível energético.
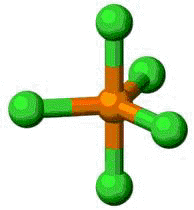
Todavia, deparamo-nos com compostos como o pentacloreto de fósforo, que foge da regra do octeto. Que reflexões são possíveis desenvolver para explicar a estruturação dessa molécula?
Dessa maneira, o presente artigo possui a pretensão de tecer reflexões a respeito de novas teorias referentes aos modelos atômicos.
Sobre os orbitais
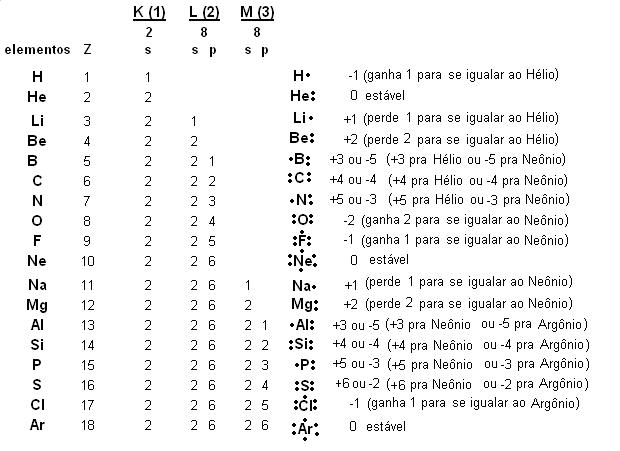
Cada orbital, também chamado de subnível de energia, possui quantidade definida de elétrons, os quais foram quantificados por estudos experimentais [1]. As respectivas quantidades conhecidas pelos cientistas são 2 para o subnível s, 6 para o p; 10 para o d; 14 para o f; 18 para o g; 22 para o h e 26 para o i e assim por diante.
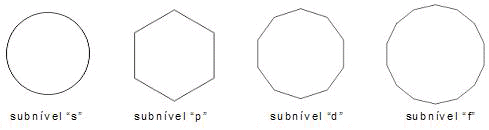
Os elétrons distribuídos nos subníveis de energia ocupam regiões complexas quanto maior for a quantidade de elétrons. De forma simplista, foi definido que o subnível s possui um aspecto de uma região esférica com um eixo apenas; que os elétrons ocupam o subnível p em uma região em forma de halteres em três eixos; complicando-se ainda mais a visualização para os demais subníveis.
Sendo assim, uma simplificação plana pode ser usada para visualizar a ordem de distribuição dos elétrons.
Planificação dos orbitais
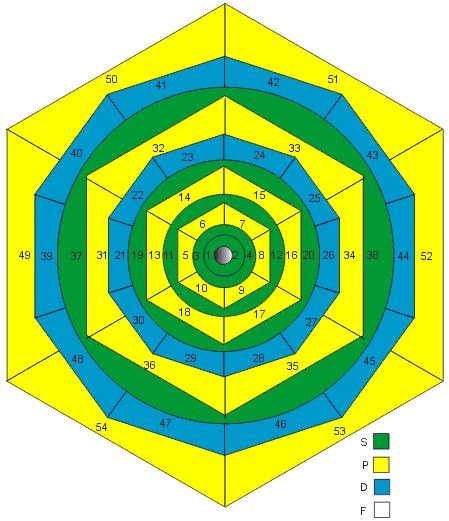
Considerando as quantidades de elétrons dos subníveis, ou seja, 2, 6, 10, 14, 18, 22 e 26, e as figuras abaixo representando a esfera o subnível s, o hexágono o subnível p, o decaedro o d e assim por diante, a idéia consiste sobrepor as figuras numa sequência que será explicada adiante.
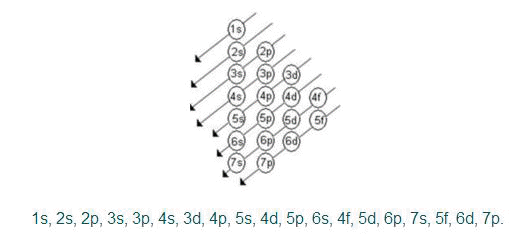
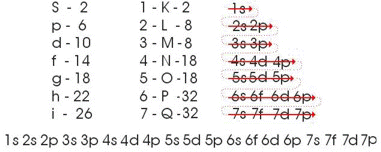
a) o diagrama de Linus Pauling
Segundo Linus Pauling, um átomo em estado fundamental, isolado ou neutro, apresenta os seus elétrons em ordem crescente de energia, ou seja, os elétrons ocupam primeiramente os subníveis de menor energia. Dessa maneira, elaborou um dispositivo prático que permite colocar todos os subníveis de energia conhecidos em ordem crescente de energia. É o processo das diagonais, denominado diagrama de Pauling, representado a seguir. A ordem crescente de energia dos subníveis é a ordem na sequência das diagonais [2].
b) reflexões sobre um diagrama geométrico
O Hélio é um gás nobre que adquire estabilidade com dois elétrons, os quais se distribuem nesse átomo sob a forma de uma esfera. Outros gases nobres, com mais elétrons, possuem em seu último subnível seis elétrons, os quais se dispõem nos vértices de octaedros.
Dessa maneira, pode-se dizer que um átomo adquire estabilidade quando, após ganhar ou perder elétrons, atinge uma forma geométrica estável de um gás nobre quando este dispuser em seu subnível de seis elétrons, segundo os vértices de um octaedro. Para os metais de transição, além da forma geométrica dos orbitais octaédricos, a estabilização também ocorre sob a forma geométrica de um hexaedro, com seus oito elétrons no último subnível.
Considerando a sequência de distribuição oferecida por Linus Pauling, ou seja, 1s2, 2s2, 2p6, 3s2..., temos a seguinte sequência de subníveis:
Afere-se da tabela periódica que “cada período começa no subnível s e termina no p”.
Então, tomei uma divisão periódica começando no subnível s e terminando no subnível p, conforme segue:
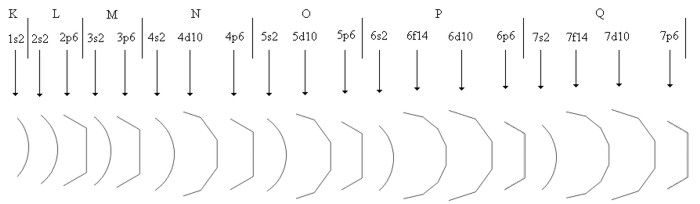
Os elétrons foram então distribuídos, obedecendo-se a seqüência acima, o que resultou na seguinte distribuição sequencial:
1s2 / 2s2 2p6 / 3s2 3p6 / 4s2 4d10 4p6 / 5s2 5d10 5p6 / 6s2 6f14 6d10 6p6 / 7s2 7f14 7d10 7p6
Disso decorre com base na sequência acima, que é possível planificar geometricamente a distribuição eletrônica.
E, dessa forma, juntando-se geometricamente a composição acima, podemos apresentar um diagrama geométrico sobre o qual se pode inscrever os átomos de forma sequenciada, segundo a ordem numérica apontada no diagrama abaixo, onde o número 1 seria representado pelo H, o 2 pelo He e assim por diante.
Veja a mesma figura com os 118 elementos clicando aqui
A distribuição eletrônica proposta no diagrama acima implica uma alteração da sequência inicialmente proposta por Linus Pauling, sendo então apresentada na forma descrita abaixo:
c) Tabela de valência.
A apresentação da distribuição eletrônica desenvolvida no item b acima permite construir a seguinte tabela de valência:
Com base na tabela acima, é possível fazer observações quanto aos compostos indicados abaixo:
Pentacloreto de Fósforo
Da tabela de valência do tópico anterior percebe-se que o átomo de fósforo possui na camada M 5 elétrons, sendo 2 no subnível s e 3 no p.
Dessa maneira, o fósforo possui 5 elétrons na camada de valência M, o que o permite fazer a ligação com 5 átomos de cloro, doando os seus cinco elétrons, um para cada Cloro. Assim o Fósforo atinge a configuração eletrônica do gás nobre Neônio e os átomos de Cloro atingem a configuração eletrônica do gás nobre Argônio.
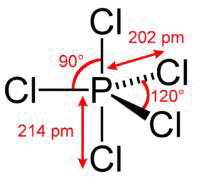
Imagens obtidas do site http://pt.wikipedia.org/wiki/Pentacloreto_de_fósforoTricloreto de Fósforo
Da mesma tabela de valência percebe-se que o átomo de fósforo possui no subnível p 3 elétrons.
Dessa maneira, o fósforo possui 3 elétrons no subnível p, o que o permite fazer a ligação com 3 átomos de cloro, compartilhando os seus três elétrons, um com cada Cloro. Assim o Fósforo atinge a configuração do gás nobre Argônio, e os átomos de Cloro também atingem a configuração eletrônica do gás nobre Argônio.
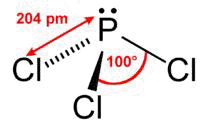
Imagens obtidas do site http://pt.wikipedia.org/wiki/Tricloreto_de_fósforoHexafluoreto de enxofre
O Enxofre doa seus seis elétrons, ou seja 4 do subnível p e 2 do subnível s, um para cada átomo de flúor, assim ambos atingirão a configuração eletrônica do Neônio.
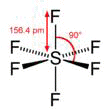
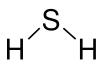
Imagens obtidas do site http://pt.wikipedia.org/wiki/Hexafluoreto_de_enxofreSulfeto de hidrogênio
No caso do sulfeto de hidrogênio o Enxofre compartilha dois dos seus 4 elétrons do subnível p, um para cada Hidrogênio, Assim o hidrogênio atinge a configuração do gás nobre Helio e o Enxofre atinge a configuração do Argônio.

Imagens obtidas do site http://pt.wikipedia.org/wiki/Sulfeto_de_hidrogênioConclusão
O presente texto explorou a possibilidade de uma nova sequência de distribuição eletrônica, que chamei de Modelo Atômico de Orbitais Geométricos – M.A.O.G, o qual permite organizar a distribuição eletrônica sobre uma nova configuração de diagrama.
A idéia de distribuição conforme uma seqüência geométrica definida permite explicar a estabilidade de alguns compostos até então mal compreendidos, como o pentacloreto de fósforo e o tricloreto de fósforo.
Assim, a idéia do Modelo Atômico de Orbitais Geométricos demanda uma confrontação ao princípio da incerteza apresentado por Heisemberger, o qual será desenvolvido num próximo texto.
Por fim, este trabalho lança a discussão sobre o tema do Modelo Atômico de Orbitais Geométricos aqui apresentado, e o autor se disponibiliza em discuti-lo com os interessados, pelo e-mail informado abaixo.
m a o g @ b r t u r b o . c o m . b r
* * * * *
- VIEIRA, Ricardo Soares: Teoria das diagonais energéticas.
- Tabela Periódica Online: Distribuição eletrônica de Linus Pauling.